Ritterova reakce
Ritterova reakce je organická reakce, při které se mění nitrily na N-alkylované amidy působením elektrofilních alkylačních činidel; při původní reakci byl použit alken za přítomnosti silné kyseliny.[1][2][3][4]
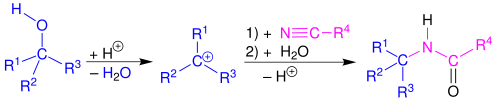
Mechanismus a rozsah
[editovat | editovat zdroj]Ritterova reakce začíná elektrofilní adicí karbeniového iontu nebo kovalentní částice na nitril.[5][6] Vzniklý nitriliový ion se poté hydrolyzuje na amid.

Do těchto reakcí mohou vstupovat také primární,[7] sekundární,[4] terciární[8] a benzylové alkoholy[9][1] a také terc-butylacetát.[10]
Lze použít mnoho různých nitrilů, například z formonitrilu (kyanovodíku) se stávají formamidy, využitelné při přípravě isonitrilů.
Použití
[editovat | editovat zdroj]Nejvýznamnějším využitím Ritterovy reakce je výroba terc-oktylaminu a dalších lipofilních aminů.[11] Ritterova reakce slouží také k získávání aminů a amidů při výrobě léků, jako jsou indinavir (léčivo proti HIV);[12] PK-11195 (inhibitor falcipainu-2), alkaloid aristotelon[13] a amantadin, používaný jako antivirotikum a na léčbu Parkinsonovy nemoci.[14] Ritterova reakce je také součástí syntézy ligandů dopaminového receptoru[13] a přípravy racemického amfetaminu z allylbenzenu a acetonitrilu.[1][15]
Oproti Ritterově se častěji používají jiné aminační reakce, protože při ní vznikají velká množství solí; jako příklad lze uvést přeměnu isobutenu na terc-butylamin pomocí kyanovodíku a kyseliny sírové a následné neutralizace zásadou, kde je hmotnost vytvořené soli větší než hmotnost aminu.[11]
Překážkou pro laboratorní Ritterovy reakce je potřeba velmi silné kyseliny jako katalyzátoru. Bylo navrženo několik postupů podporujících tvorbu karbokationtu, například fotokatalytický přenos elektronu[16] a přímá fotolýza.[17]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ritter reaction na anglické Wikipedii.
- ↑ a b c L. I. Krimen; Donald J. Cota. Organic Reaction Volume 17. London: John Wiley & Sons, 1969. ISBN 9780471196150. DOI 10.1002/0471264180.or017.03. S. 213–326.
- ↑ Francis Johnson; Ramón Madroñero. Heterocyclic Syntheses Involving Nitrilium Salts and Nitriles under Acidic Conditions. Advances in Heterocyclic Chemistry. 1966, s. 95–146. ISBN 9780120206063. DOI 10.1016/S0065-2725(08)60576-0.
- ↑ Zvi Rappoport; A. I. Meyers; J. C. Sircar. The Cyano Group. [s.l.]: Wiley Interscience, 1970. Dostupné online. ISBN 9780471709138. DOI 10.1002/9780470771242.ch8. S. 341–421.
- ↑ a b Roger Bishop. Comprehensive Organic Synthesis Volume 6: Heteroatom Manipulation. [s.l.]: [s.n.], 1991. ISBN 9780080359298. DOI 10.1016/B978-0-08-052349-1.00159-1. Kapitola Section 1.9 – Ritter-type Reactions, s. 261–300.
- ↑ Brian L. Booth; Kehinde O. Jibodu; M. Fernanda J. R. P. Proença. The chemistry of nitrilium salts. Part 2. The preparation of nitrilium trifluoromethanesulphonate salts and their reactions with some oxygen and sulphur nucleophiles. Journal of the Chemical Society, Perkin Transactions 1. 1983, s. 1067–1073. DOI 10.1039/P19830001067.
- ↑ A. García Martínez. An improved modification of ritter reaction. Tetrahedron Letters. 1989, s. 581–582. DOI 10.1016/S0040-4039(00)95260-2.
- ↑ Mikhail Y. Lebedev; Mark B. Erman. Lower primary alkanols and their esters in a Ritter-type reaction with nitriles. An efficient method for obtaining N-primary-alkyl amides. Tetrahedron Letters. 2002, s. 1397–1399. DOI 10.1016/S0040-4039(02)00057-6.
- ↑ J. J. Ritter; J. Kalish. α,α-Dimethyl-β-phenethylamine. Organic Syntheses. 1964, s. 16. DOI 10.15227/orgsyn.042.0016.
- ↑ C. L. Parris. N-Benzylacrylamide. Organic Syntheses. 1962.
- ↑ H. Fernholz; H. J. Schmidt. Tert-Butyl Acetate as Alkylating Agent. Angewandte Chemie International Edition in English. 1969, s. 521. DOI 10.1002/anie.196905211.
- ↑ a b ELLER, Karsten; HENKES, Erhard; ROSSBACHER, Roland. Amines, Aliphatic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a02_001. S. a02_001. (anglicky) DOI: 10.1002/14356007.a02_001.
- ↑ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. Organic Chemistry; Oxford Press: New York, 2001
- ↑ a b Kurti, L.; Czako, B. (2005). Strategic Applications of Named in Organic Synthesis. Burlington, MA Elsevier Academic Press
- ↑ Vardanyan, R.; Hruby, V. J. Synthesis of Essential Drugs, 1st Ed. Amsterdam: Elsevier, 2006; 137
- ↑ Fujisawa and Deguchi, Chemical Abstracts, 52, 11965 (1958)
- ↑ Susan L. Mattes; Samir Farid. Photosensitized electron-transfer reactions of phenylacetylene. Journal of the Chemical Society, Chemical Communications. 1980, s. 126. DOI 10.1039/C39800000126.
- ↑ Paul J. Kropp; Graham S. Poindexter; Norbert J. Pienta; David C. Hamilton. Photochemistry of alkyl halides. 4. 1-Norbornyl, 1-norbornylmethyl, 1- and 2-adamantyl, and 1-octyl bromides and iodides. Journal of the American Chemical Society. 1976, s. 8135. DOI 0.1021/ja00441a043.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Ritterova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ritterova reakce na Wikimedia Commons
Literatura
[editovat | editovat zdroj]- RITTER, John J.; MINIERI, P. Paul. A New Reaction of Nitriles. I. Amides from Alkenes and Mononitriles. Journal of the American Chemical Society. 1948, s. 4045–8. DOI 10.1021/ja01192a022. PMID 18105932.
- RITTER, John J.; KALISH, Joseph. A New Reaction of Nitriles. II. Synthesis of t-Carbinamines. Journal of the American Chemical Society. 1948, s. 4048–50. DOI 10.1021/ja01192a023. PMID 18105933.
- ZIL'BERMAN, E. N. Some reactions of nitriles with the formation of a new nitrogen–carbon bond. Russian Chemical Reviews. 1960, s. 331–340. DOI 10.1070/RC1960v029n06ABEH001235. Bibcode 1960RuCRv..29..331Z.
